COMBUSTIÓN Y COMBUSTIBLES
Con esta entrada, queremos dar a conocer todo lo necesario que se debería saber sobre la combustión. A continuación hablaremos sobre: ¿Qué es la combustión?, los tipos de combustibles que existen, las reacciones de combustión, tipos de combustión (se dará una pequeña explicación sobre el poder calorífico), sobre la teoría de llama, cuales son los productos de la combustión y la herramienta necesaria para el análisis de la combustión.
¿QUÉ ES LA COMBUSTIÓN?
La combustión es una reacción química entre dos sustancias, combustible y comburente, en la que se libera energía, en forma de calor principalmente.
Los componentes del combustible susceptibles de ser quemados (carbono, hidrógeno y azufre) se oxidan al combinarse con el oxígeno que aporta el comburente. Generalmente se utiliza el aire como comburente, que además de oxigeno (21%), aporta a la reacción otros elementos, como el nitrógeno (78%), vapor de agua, dióxido de carbono y gases nobles en pequeñas proporciones (1% restante).
El proceso de combustión se inicia con la aplicación de una fuente de calor a una mezcla lo suficientemente rica de combustible y comburente, produciéndose una reacción rápida de oxidación del combustible, que se manifiesta en forma de llama.

El proceso de combustión se realiza en tres fases:
- En una primera fase se produce una pre-reacción en la que los hidrocarburos se descomponen para reacciones con el oxígeno, formando unos compuestos inestables.
- La segunda fase es la oxidación, en la cual se libera la mayor parte del calor.
- En la tercera fase se completa la oxidación y se forman los productos estables que serán los componentes de los gases de combustión.
REACCIÓN DE COMBUSTIÓN
La reacción de combustión se basa en la reacción química exotérmica de una sustancia o mezcla de sustancias llamada combustible con el oxígeno. Es característica de esta reacción la formación de una llama, que es la masa gaseosa incandescente que emite luz y calor, que esta en contacto con la sustancia combustible.
La reacción de combustión puede llevarse a cabo directamente con el oxigeno o bien con una mezcla de sustancias que contengan oxígeno, llamada comburente, siendo el aire atmosférico el comburente más habitual.
La reacción del combustible con el oxígeno origina sustancias gaseosas entre las cuales las más comunes son CO2 y H2O. Se denominan en forma genérica productos, humos o gases de combustión. Es importante destacar que el combustible solo reacciona con el oxigeno y no con el nitrógeno, el otro componente del aire. Por lo tanto el nitrógeno del aire pasará íntegramente a los productos de combustión sin reaccionar.
Las reacciones químicas que se utilizan en el estudio de las combustiones técnicas tanto si se emplea aire u oxigeno, son muy sencillas y las principales son:
C + O2 → CO2 || CO + 1⁄2 O2 → CO2 || H2 + 1⁄2 O2 → H2O || S + O2 → SO2 || SH2 + 3⁄2 O2 → SO2 + H2O
Entre las sustancias más comunes que se pueden encontrar en los productos o humos de la reacción se encuentran:
CO2 : Dióxido de Carbono, H2O : Vapor de Agua, N2 : Nitrógeno gaseoso, O2 : Oxigeno gaseoso, CO : Monóxido de Carbono, H2 : Hidrogeno gaseoso, Carbono en forma de hollín, SO2 : Dióxido de Azufre
De acuerdo a como se produzcan las reacciones de combustión, estas pueden ser de distintos tipos.
TIPOS DE COMBUSTIÓN
Dependiendo de las proporciones en que intervienen el combustible y el comburente en la reacción de combustión, podemos definir tres tipos de combustiones:
- Combustión incompleta: es la que se produce con defecto de oxígeno, al aportarse a la reacción de combustión una cantidad de aire menor a la necesaria para quemar completamente el combustible disponible. Este tipo de combustión favorece la formación de monóxido de carbono (CO), en lugar del dióxido de carbono (CO2) que se produce en las combustiones completas. Además de producir un gas altamente tóxico, resulta antieconómica al quedar restos de combustible sin quemar que se eliminan con los humos.
- Combustión completa: la reacción de combustión completa es la que se produce con un exceso de oxígeno, lo que garantiza la combustión total del combustible. De esta forma se aprovecha al máximo el combustible disponible,
pero se generan pérdidas de calor, al eliminarse mayor cantidad de gases junto con los humos. - Combustión neutra (o estequiométrica): en este tipo de combustión se aporta a la reacción la cantidad de aire estrictamente necesaria para quemar completamente todo el combustible disponible.
- Combustión con exceso de aire: Es la reacción que se produce con una cantidad de aire superior al mínimo necesario. Cuando se utiliza un exceso de aire, la combustión tiende a no producir sustancias combustibles en los gases de reacción. En este tipo de combustión es típica la presencia de oxígeno en los gases de combustión.
La razón por la cual se utiliza normalmente un exceso de aire es hacer reaccionar completamente el combustible disponible en el proceso. - Combustión con defecto de aire: Es la reacción que se produce con una menor cantidad de aire que el mínimo necesario. En este tipo de reacción es característica la presencia de sustancias combustibles en los gases o humos de reacción.
En la práctica, se trata de conseguir combustiones completas, que se aproximen a ala combustión neutra. Hay que tener en cuenta que para favorecer la reacción de combustión, debe mezclarse lo mejor posible el combustible con el comburente, y esto resulta más fácil cuanto mayor es la cantidad de aire que se aporta a la combustión.
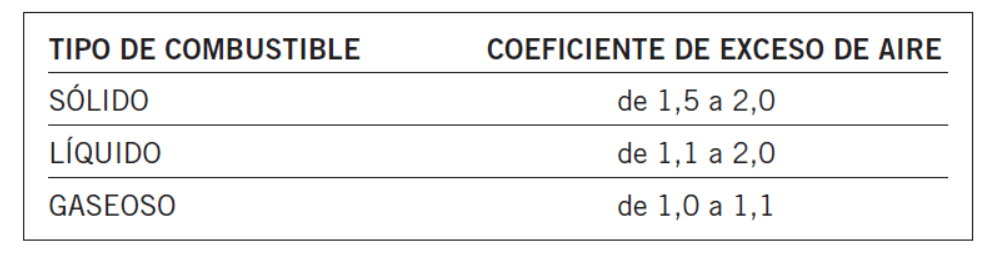
Para determinar el exceso de aire que se aporta a la combustión se utiliza el coeficiente de exceso de aire, que se define como la relación entre la cantidad de aire introducida y la estrictamente necesaria para llevar a cabo la combustión.

Dependiendo del tipo de combustible, se recomienda un valor para el coeficiente de exceso de aire:
TIPOS DE COMBUSTIBLES
Los combustibles son sustancias de origen natural o artificial con un alto contenido en carbono e hidrógeno, a los que acompañan impurezas, entre la que podemos destacar el azufre.
Entre los combustibles naturales podemos encontrar la biomasa, biogases y los combustibles fósiles (carbón y petróleo) que son los más utilizados.
Los combustibles artificiales son los que se obtienen por procesos de destilación, piro-génesis de combustibles naturales o como subproductos de algún proceso industrial.
Existen diversos criterios para clasificar los combustibles, entre ellos cabe destacar los siguientes:
- Por su estado físico: sólidos, líquidos y gaseosos. Será determinante para establecer la forma en que se realiza la combustión.
- Por su peligrosidad de manejo: se utiliza para clasificar los hidrocarburos (derivados del petróleo):
- Clase A: corresponde a gases licuados del petróleo, cuya tensión de vapor es inferior a 1 kg/cm2 a la temperatura de 0° C (metano, propano, butano,…).
- Clase B: hidrocarburos con punto de inflamación inferior a 55° C y que no están incluidos en la clase A (gasolina, petróleo y disolventes).
- Clase C: hidrocarburos con punto de inflamación comprendido entre 55° C y 120° C (gasoil, diesel y fuel oil).
- Clase D: hidrocarburos con punto de inflamación superior a 120° C (asfaltos y lubricantes).
Esta clasificación establece las normas técnicas y de seguridad que deben aplicarse para su manejo, transporte y almacenamiento. A los hidrocarburos de clase A se les aplica el Reglamento de Combustibles Gaseosos. Los de clase B y C se someterán al Reglamento de Combustibles Líquidos. Para todos los combustibles se definen una serie de características que establecen cuál será su comportamiento durante el proceso de la combustión:
- Temperatura de inflamación: temperatura mínima hasta la que hay que calentar el combustible, para que se inicie la reacción de combustión.
- Temperatura de ignición: temperatura necesaria para que la llama originada por la combustión sea duradera y persistente, mientras quede combustible.
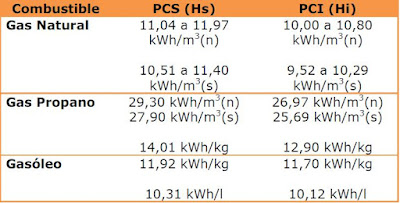
- Poder calorífico: calor producido por la combustión completa de la unidad de masa del combustible; se expresa en Julios/kilogramo.
- Poder calorífico superior: calor cedido en la combustión completa de la unidad de peso del combustible, en oxígeno, enfriando los productos resultantes de la combustión hasta la temperatura inicial de suministro del oxígeno (15° C).
- Poder calorífico inferior: calor que se obtiene de la combustión completa de la unidad de peso del combustible, en oxígeno, enfriando los productos resultantes de la combustión hasta 100° C y sin condensar el vapor.
- Contenido de humedad: cantidad de agua contenida en el combustible; se expresa en %.
- Cantidad de cenizas producidas: residuo sólido resultante de la combustión completa de un combustible.
- Poder comburívoro: cantidad de aire mínima que necesita un combustible para que se verifique la combustión completa del mismo.
- Poder fumígeno: peso de humos producidos en la combustión.
PODER CALORÍFICO
Se define el Poder Calorífico de una sustancia o combustible como la cantidad de calor que se genera, por kilogramo o metro cúbico de esa sustancia, al oxidarse de forma completa.
La mayoría de los combustibles son compuestos de carbono e hidrógeno, que al arder se combinan con el oxígeno formando dióxido de carbono (CO2) y agua (H2O).
Por ejemplo, en el caso del Metano (CH4) se tendría la siguiente reacción de oxidación para generar dióxido de carbono (CO2), agua (H2O), además del calor que se desprende: CH4 + 2O2 → CO2 + 2H2O + Calor
Las unidades más usuales para medir el poder calorífico, es decir, el calor generado en la reacción son: kcal/kg ; kcal/m3 ; BTU/lb ; BTU/pie3
El poder calorífico siempre se mide por unidad de masa o unidad de volumen de combustible que se ha oxidado (quemado).
El vapor de agua (H2O) que se genera en una reacción de oxidación (o combustión) es debida, bien por la combustión del hidrógeno presente en la composición del combustible, o bien, procedente de la misma humedad adherida al propio combustible.
Por otro lado, se denomina calor de cambio de estado a la energía requerida por una sustancia para cambiar de fase, de sólido a líquido (calor de fusión) o de líquido a gaseoso (calor de vaporización). El agua, en concreto, tiene un calor de vaporización y de fusión altos ya que, para romper los puentes de hidrógeno que enlazan las moléculas de agua, es necesario suministrar mucha energía.
Pues bien, la presencia de agua en los gases resultantes de la combustión va a condicionar que se pueda definir dos tipos de Poder calorífico: Poder Calorífico Superior y Poder Calorífico Inferior.
• Poder Calorífico Superior: El poder calorífico superior (PCS) se define cuando todos los elementos que intervienen en la reacción de combustión (combustible y aire) son tomados a 0 ºC y los productos resultantes (gases de la combustión) son llevados también a 0 ºC. Por tanto, el vapor de agua que se genere se encontrará totalmente condensado, es decir, ha cambiado de fase. Por tanto, en este caso también habrá que contabilizar el calor desprendido en el cambio de fase de vapor de agua a agua líquida. El PCS también es llamado poder calórico neto.
Por tanto, al condensar el vapor de agua que se desprende durante la combustión se conseguirá un aporte adicional de calor debido al cambio de fase del agua, en concreto: 597 kcal/kg de vapor de agua condensado.
• Poder Calorífico Inferior: el poder calorífico inferior (PCI) se define suponiendo que el vapor de agua contenido en los gases resultante de la combustión no condensa, es decir, el agua resultante no cambia de fase y se desprende en forma de vapor. Por tanto, en este caso hay una parte del calor generado que se gasta para llevar a cabo la condensación del agua en forma de vapor.
Así, en esta ocasión, de la reacción de combustión sólo se obtendrá el calor de oxidación del combustible, sin contar la parte correspondiente al calor latente del vapor de agua, ya que no se produce cambio de fase, sino que se expulsa en forma de vapor. Por ello se define en este caso el Poder Calorífico Inferior del Combustible.
Para aprovechar el PCS son necesarias calderas específicamente diseñadas para ello, que se denominan calderas de condensación. Una caldera que no sea de condensación, se debe calcular con el PCI.
La relación entre los poderes caloríficos superior e inferior viene dada por la siguiente expresión:
PCS = PCI + 597·G
donde,
PCS: es el Poder Calorífico Superior ( kcal/kg de combustible)
PCI: es el Poder Calorífico Inferior ( kcal/kg de combustible)
597: es el calor de condensación del agua a 0 ºC ( kcal/kg de agua)
G: es el porcentaje de peso del agua formada por la combustión del hidrógeno presente en la composición del combustible, o de la propia humedad del combustible ( kg de agua / kg de combustible).
Siendo G = 9·H + H2O
donde,
9: son los kilos de agua que se forman al oxidar un kilo de hidrógeno
H: es el peso de hidrógeno contenido por kg de combustible
H2O: es el peso de agua debido a la humedad presente en el combustible, por kg de combustible.
TEORÍA DE LA LLAMA
La llama puede definirse como una reacción de combustión que se propaga a través de espacio, a velocidad inferior a la del sonido. El concepto de llama implica el de movimiento y por consiguiente, un frente de avance de la reacción denominado frente de llama.
La forma que tiene la llama, o masa de combustibles en combustión, depende del medio técnico que prepara el combustible, el comburente, la mezcla de ambos y aporta la energía de activación, que es el quemador.
Para que tenga lugar la combustión se tiene que alcanzar la temperatura de ignición, muy superior a la del punto de inflamación que es aquella en la que el combustible esta en condiciones de iniciar la combustión, pero si se retira la energía de activación, la llama e apaga. A partir de ello, todas las reacciones de combustión en sus distintas fases, tiene lugar en este medio gaseoso que es la llama. Una vez iniciada, si se aportan el combustible y comburente suficiente, a la misma velocidad con que se propaga el frente de llama, la llama se estabiliza y persiste, aunque se retire la energía de activación inicial.
La velocidad de propagación de la llama depende de cada combustible, de su mayor o menor grado de pureza y del exceso de aire con que se efectúa la combustión. La temperatura de la llama depende del poder calorífico, exceso de aire y del tipo de hogar o cámara de combustión. Se conoce como temperatura teórica de llama adiabática a la mayor temperatura que se puede obtener de un combustible, la cual se alcanza cuando no hay exceso de aire. En cuanto al color, depende del combustible. En general se puede decir que debe ser clara y luminosa, sin productos humeantes. Cuando hay falta de aire, la llama se oscurece y humea debido a partículas de carbono incandescentes.
¿CUÁLES SON LOS LOS PRODUCTOS DE LA COMBUSTIÓN?
Como resultado de la combustión se genera, además de energía, una serie de residuos o productos contaminantes, que se eliminan en forma de humo y cenizas, y que pueden ser:
- Restos de combustibles no quemados (Hidrocarburos, H2O2,…) o parcialmente quemados (CO y partículas de carbono sólidas no quemadas) resultado de combustiones incompletas.
- Impurezas presentes en el combustible, quemadas o no (SO2, cenizas,…).
- Componentes del aire, quemados o no (NO, NO2, O2, N2…).
- Componentes del combustible quemados (CO2 y H2O).
Cada uno de estos productos tiene unas propiedades distintas, que lo hacen más o menos perjudiciales para el entorno (contaminación atmosférica) o para la propia instalación de producción de calor:
- Dióxido de Carbono (CO2): gas responsable del efecto invernadero.
- Monóxido de Carbono (CO): gas muy tóxico procedente de combustiones incompletas.
- Dióxido de azufre (SO2): resultado de la oxidación del azufre presente como impureza en el combustible, que en contacto con el agua procedente de las condensaciones o con la humedad ambiental puede formar ácido sulfúrico, que puede dañar gravemente los componentes de la instalación. Es el responsable de la lluvia ácida.
Diagrama de Ostwald
Si se analiza la composición porcentual de los humos resultantes de la combustión, es posible representar gráficamente el resultado obtenido y dibujar así el denominado triángulo de la combustión, que resultará distinto para cada combustible.
En está gráfica podemos definir los siguientes elementos:
- Recta de combustión perfecta: representa la línea en la que todo el carbono se quema y se transforma en CO2.
- Rectas de igual contenido de CO: son líneas paralelas a la recta de combustión completa que permiten determinar la cantidad de CO que se produce cuando la combustión es incompleta.
- Rectas de igual exceso de aire: nos indican el coeficiente de exceso de aire de la combustión, siendo la más importante de todas ellas la línea de aire, que divide la gráfica en dos zonas, la que corresponde a combustiones que se verifican con exceso de aire y las que corresponde a combustiones con defecto de aire.
A partir de esta gráfica se puede determinar la calidad de la combustión que se está realizando y nos permitirá tomar las medidas necesarias para mejorarla en caso de que sea necesario.
Para utilizar el triángulo de la combustión es necesario conocer el combustible que se está quemando y los porcentajes de CO2 y de O2 presentes en el humo resultante de la combustión.

De un punto cualquiera del triángulo, podemos obtener los datos siguientes:
- Porcentaje de dióxido de carbono y de oxígeno presente en el humo.
- Coeficiente de exceso de aire.
- Porcentaje de monóxido de carbono presente en el humo.
No toda la energía liberada en la combustión puede ser aprovechada, ya que se producen unas pérdidas derivadas del mismo proceso. Estas pérdidas son las siguientes:
- Calor disipado con los gases que intervienen en la reacción de combustión y que se eliminan a mayor temperatura que la que tenían cuando se han introducido, junto con los humos resultantes.
- Pérdidas de calor por la humedad contenida en el aire y en el combustible utilizado.
- Pérdidas por la presencia de combustible no quemado en los humos.
- Pérdidas por la presencia de partículas de carbono no quemadas que se eliminan en el humo o en forma de cenizas.
Todas estas pérdidas no se pueden eliminar totalmente pero se pueden reducir si se mejora la calidad de la combustión, aportando las cantidades de aire necesarias, realizando una buena mezcla entre comburente y combustible y cuidando la calidad de este último.
ANÁLISIS DE LA COMBUSTIÓN
EL análisis de los productos de la combustión es una comprobación de especial importancia para asegurar una correcta combustión, y así detectar las combustiones con exceso de CO2, perjudicial para la seguridad de las personas y perjudicial para el medio ambiente. Los mantenedores de generadores de calor, que obtienen la energía térmica mediante combustión, deben evaluar periódicamente este rendimiento de la combustión.
La reacción de oxidación entre el hidrocarburo y el oxígeno del aire producirá unos productos de la combustión y una energía en forma de calor y luminosidad.
Cada combustible tiene una composición química distinta con una proporción diferente de átomos de carbono y de hidrógeno, por lo que el resultado de los productos de la combustión será distinto, así como la cantidad de oxígeno necesaria para su combustión.
Los valores de aire teórico necesario para la combustión (poder conburiboro) son:

Así si se combina 1 m3 de gas natural con 9,31 m3 de aire teóricamente se produciría una combustión perfecta de aparecer una chispa (energía de activación).
A esta combustión se le denomina combustión estequiométrica. Sólo es posible teóricamente, pues los átomos de carbono (C) e hidrógeno (H) disponen de poco tiempo en un quemador para reaccionar.
Por tanto en los quemadores actuales se forzará la entrada de un poco más de aire (exceso de aire) respecto del teórico para obtener una combustión completa.

Principalmente en una combustión aparecerán:
- C + O2 = CO2 (dióxido de carbono).
- H + O2 = H2O (agua, en fase gaseosa al estar a más de 100 ºC).
Además, debido a que aire contiene nitrógeno, hay un exceso de aire, la combustión puede no ser perfecta aparecerán en los productos de la combustión como el Nitrógeno (N), Monóxido de Carbono (CO), Hollín (C), Oxígeno (O), Óxidos del Nitrógeno (NOx), e incluso óxidos de azufre (SOx) si el combustible es el gasóleo pues contiene algo de azufre en su composición.
Analizando los productos de la combustión se puede determinar si la reacción de combustión ha sido completa, o bien hay inquemados, y la cantidad de calor que no se está aprovechando.
Si una reacción química completa produciría un rendimiento del 100 %, el rendimiento de la combustión, ηcmb, será:
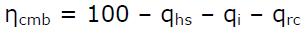
Donde se tendrán en cuenta las pérdidas de calor que se producen por:
- Chimenea, qhs.
- Inquemados, por reacciones incompletas, y formación de CO en vez de CO2.
- Radiación y convección de la caldera.
Descontadas estas pérdidas el resto del calor de la combustión se transmite al fluido portacalor como el agua (calderas o calentadores) o el aire (generadores de aire caliente).
La cantidad de calor que produce el combustible dependerá de su composición química, denominándose poder calorífico del combustible.
Estos valores deben ser contrastados con los indicados en la factura del suministro de combustible.
La diferencia entre el poder calorífico superior (Hs) y el poder calorífico inferior (Hi) es la energía del vapor de agua contenido en los productos de la combustión. Si se logra la condensación de este vapor de agua el aprovechamiento de esta energía proporcionará unas menores pérdidas y un mayor rendimiento en el generador.
El consumo calorífico del generador viene referido al poder calorífico inferior del combustible, y por ello cuando este generador tiene tecnología de condensación se pueden producir rendimientos superiores al 100 %.
ANALIZADOR DE COMBUSTIÓN
Un analizador de la combustión es un equipo que mide temperatura de los productos de la combustión y a veces simultáneamente del ambiente, y además algunos productos de la combustión como el oxígeno (o bien el dióxido de carbono), y el monóxido de carbono.

Este instrumento cumplirá las especificaciones de la Norma UNE EN 50.379, y deberá estar debidamente calibrado por el fabricante o por un laboratorio que cumpla con los requisitos de la Norma UNE EN ISO 17.025.
La calibración deberá habérsele realizado en los últimos 12 ó 18 meses según la asiduidad de las medidas, y el correcto funcionamiento del mismo.
Empleando un analizador de la combustión se obtendrá el rendimiento instantáneo de la combustión, a la vez que se verificará si la combustión es higiénica.
Con las sondas para medición de gases antes indicada y el salto térmico entre la entrada de aire al quemador y la temperatura de los humos valorará las pérdidas de calor por la chimenea. Para ello empleará una expresión de este tipo:
Donde se observa que:
- A mayor salto térmico (Thumo – Tamb) mayores pérdidas y menor rendimiento, y,
- A menor porcentaje de CO2, mayores pérdidas y menor rendimiento.
Por tanto para un buen rendimiento habrá que lograr la mínima temperatura de humos y el máximo CO2 en los productos de la combustión.
Del diseño de la caldera dependerá básicamente la temperatura de humos, pues las calderas con intercambiadores mayores podrán conseguir temperaturas de humos bajas (calderas de baja temperatura, y especialmente las calderas de condensación).
De la tecnología del quemador y de la mezcla aire-combustible, dependerá el porcentaje de dióxido de carbono conseguido (CO2).
Según el combustible hay un diagrama de la combustión, donde se observa una relación entre el oxígeno y dióxido de carbono presentes en los productos de la combustión. Así al aumentar uno, disminuye el otro, y viceversa.
Por ejemplo, en gasóleo el % de CO2 + % de O2 en zonas estables está entre un 16 y un 17 %.
En un ajuste de la combustión de un quemador se debe ajustar:
- La cantidad de combustible para proporcionar el consumo calorífico que precisa el aparato.
- La cantidad de aire para que se produzca una combustión completa del combustible, minimizando la cantidad de inquemados.
De este modo el CO2 máximo que se puede obtener en la combustión dentro de las combustiones completas será el indicado en la siguiente tabla:
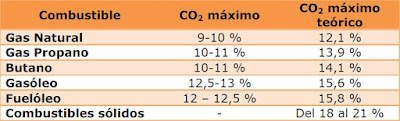
Observando que siempre será inferior el CO2 real de la combustión al CO2 máximo teórico del combustible.
Los fabricantes de grupos térmicos (caldera + quemador) nos ofrecen varios datos que deberemos observar:
- Consumo calorífico nominal, en kW. (valor referido al Hi del combustible)
- Rendimiento nominal, en las condiciones de trabajo, expresado en %.
- Temperatura de humos, en ºC.
- CO2 en %.
- CO en ppm.
- Tiro mínimo, en Pa, mbar, o mmca (1 mbar = 10 mmca = 100 Pa).
Si en un análisis de la combustión obtenemos los valores indicados por el fabricante, el ajuste del quemador será correcto.
La evolución del CO2 y del CO al variar la entrada de aire (exceso de aire) tiene la siguiente forma:
Deberemos observar en todo momento el CO de los productos de la combustión, para localizar la zona de mínimos inquemados. Pues el CO2 al aumentar reduce las pérdidas pero puede provocar problemas de inquemados si se produce una combustión incompleta tanto por defecto de aire (zona izquierda), o por gran exceso de aire con desprendimiento de llama (zona de la derecha).
En primer lugar se revisarán las mangueras y trampa de agua del analizador para comprobar la ausencia de agua. También se observará que el filtro esté limpio.
Se conectará la manguera en la toma de humos, y la sonda de temperatura en la conexión de la temperatura de humos.
Se verificará que el drenaje de la trampa de agua esté cerrado.
Si se dispone de una sonda con 2 mangueras se conectará la segunda sonda en la toma correspondiente para medición de la sobrepresión o depresión de la chimenea.
Se arrancará el analizador en una zona de aire limpio y se observará que los valores de:
- Oxígeno indica un 20,9 ó 21 %.
- CO indica 0 ppm.
- La temperatura ambiente es correcta.
En los ajustes previos del analizador se comprobará que está en fecha y hora, así como que el oxígeno de referencia es del 3 %, para que efectúe correctamente el cálculo del exceso de aire, y el valor del CO corregido (no diluido). Seleccionando el combustible con el que se van a realizar las pruebas.
El protocolo de puesta en marcha obliga a tener en marcha el aparato en máximo potencia, al menos 5 minutos (2 minutos en una revisión o inspección de gas), antes de introducir la sonda en el centro de la salida de humos.
La toma de humos estará lo más cerca posible de la caja de humos del aparato y alejado de zona de turbulencias (codos, tes,…). No existirá holgura entre la sonda y el orificio de toma de humos.

En cuanto a valores límite la normativa actual no establece más límite que 500 ppm de CO corregido (no diluido). Algunas Comunidades Autónomas los establecen en 200 ppm.
Y en cuanto a rendimiento este deberá ser lo más próximo posible a su rendimiento nominal, no permitiéndose menos de 5 puntos del indicado en su marcado energético durante la puesta en marcha del generador. Ni menos del 80 % en una prueba de eficiencia energética.
Recordemos que una buena contrastación es observar los valores indicados por el fabricante en su manual de puesta en marcha del aparato y tablas técnicas. Pues cualquier desviación indicará un funcionamiento anómalo del conjunto caldera-quemador.
Veamos algunos ejemplos de combustión:

En propano el valor de %CO2 aumentará entorno a + 1 % respecto al gas natural.
Siempre se deberá anotar la temperatura de la caldera en el momento de la analítica de combustión. Y se habrá dejado la sonda en la posición de la medida al menos 2 minutos sin que se observen oscilaciones en los valores medidos. Si se produjera esta oscilación se deberá anotar los valores máximos observados.
En una prueba de eficiencia energética la caldera deberá haber alcanzado los 70 ºC o bien estar como mínimo 10 ºC por debajo de la temperatura de trabajo.
Si quieres cuidar tu analizador, no introducirás la sonda durante arrancadas y paradas del quemador, y lo extraerás inmediatamente en caso de subida incontrolada del valor de CO.
ASPECTOS IMPORTANTES QUE INFLUYEN EN LA COMBUSTIÓN
En calderas alimentadas con combustibles sólidos, si se sospecha de una mala combustión (presencia de humo negro, llama muy oscura, etc) se deberá realizar una determinación previa del Índice de Bacharach, y sólo se empleará el analizador si el resultado obtenido está entre 0 y 1.

Realmente con las calderas de última generación no hay valores idóneos que puedan ser aplicados de unas a otras.
Queda claro que el rendimiento aumentará a medida que se disminuya la temperatura de humos, y se aumente el porcentaje de CO2 en los productos de la combustión. Pero el aumento del CO2 puede conllevar un aumento incontrolado del peligroso CO con los problemas para el hogar de la caldera y especialmente para la seguridad de las personas.
La tabla siguiente muestra a modo de ejemplo, como varía el rendimiento de la combustión en función del resultado de la combustión y la temperatura de los PdC.
Cualquier valor que podemos desear, no será factible si la cámara de combustión no lo permite, influyendo aspectos importantes como el diseño del hogar de la caldera, la superficie de intercambio, número de pasos y su estrechez, uso de turbuladores, sobrepresión que se producirá en la cámara de combustión al producirse la combustión, etc. Además influye el diseño del sistema de combustión del quemador, mezcla aire y combustible, la temperatura de ambos, etc.
Pero otros factores externos también influyen como las entradas de aire incontroladas, debidas a que las puertas no cierren correctamente.
Un elemento vital es la chimenea, pues será perjudicial tanto un exceso, como un defecto de tiro. Si el tiro es excesivo, los gases de la combustión saldrán demasiado pronto de la cámara de combustión y del intercambiador de calor aspirados por la chimenea. Y un defecto de tiro creará problemas de evacuación de los gases de la combustión, ensuciamiento del hogar, o ahogamiento de la llama.
En calderas con combustibles sólidos, el hollín depositado en paredes de pasos de humos y el hogar de la caldera crearán una capa aislante que impedirá la transmisión de calor al fluido portacalor, aumentando la temperatura de humos y disminuyendo rápidamente el rendimiento. Si siguiera acumulándose hollín alcanzaría la chimenea, seguiría aumentando la temperatura de humos, creando problemas de seguridad a la instalación, bienes y/o las personas.
Por tanto el primer criterio será reducir al mínimo los inquemados como el hollín (átomos de carbono sin quemar) y el peligroso monóxido de carbono (CO).
Recordemos que el CO es un átomo de carbono que no ha terminado de reaccionar para formar CO2 y por tanto queda una parte de la energía por producirse.
El valor de monóxido de carbono será inaceptable para un profesional si alcanza las 200 ppm.