«El agua: cambios de estado y curva de calentamiento»
El agua cubre más de dos tercios de la superficie terrestre, y proporciona la base para la existencia de todos los seres vivos. Sin agua la vida no existiría.
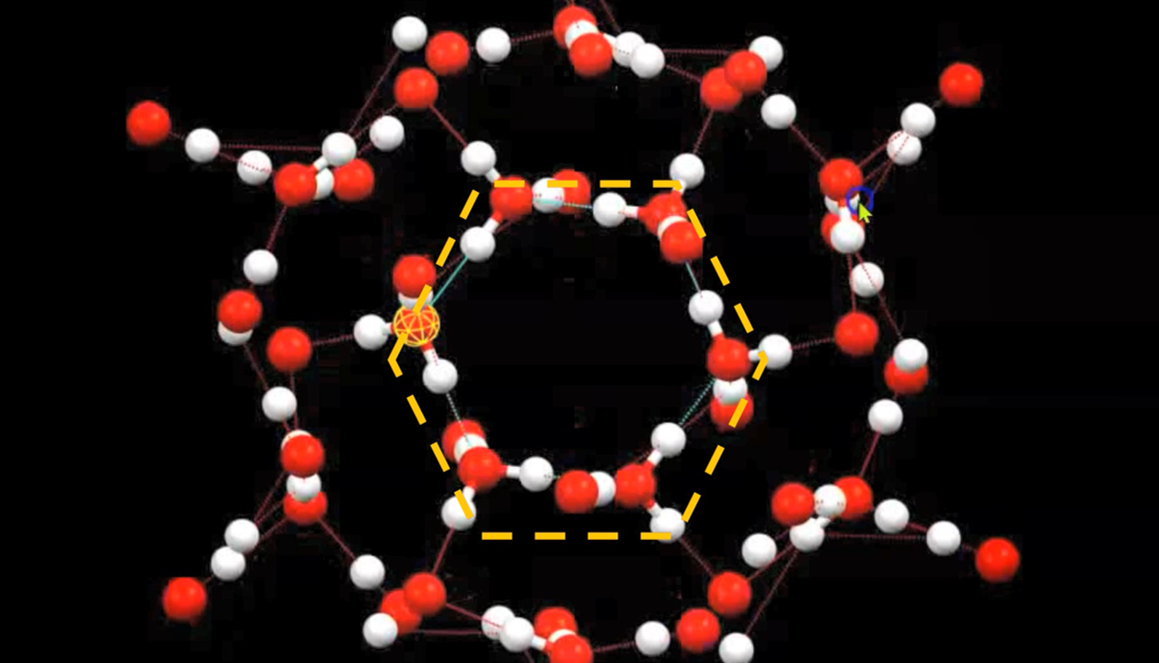
En sus tres estados de agregación, sólido, líquido y gas, sus moléculas contienen un átomo de oxígeno y dos de hidrógeno. La molécula interacciona con otras moléculas de agua e, incluso en estado sólido, forman estructuras hexagonales muy abiertas debido a la direccionalidad de los denominados «enlaces de hidrógeno», proporcionando así un mayor volumen. De lo anterior se deduce que el hielo tiene una menor densidad por lo que flota sobre agua líquida.
En este aprendizaje, el alumnado de 2º ESO se familiariza con las propiedades del agua y determina sus cambios de estados realizando una curva de calentamiento.
En estado sólido, la vibración de sus moléculas aumenta, a medida que vamos calentando. Una vez se alcanza la temperatura de fusión, el perfil de temperatura se mantiene constante hasta su completa transformación en agua líquida. Un calentamiento posterior lleva a esta a una temperatura de 100 °C, su temperatura de ebullición. De nuevo el perfil es constante y todas las moléculas de agua tienden a escapar del líquido.
Ebullición: toda la masa de agua alcanza 100 °C y hace que todas las moléculas tiendan a escapar del líquido.
Evaporación: solamente las moléculas de la superficie tienden a escapar del líquido y ocurre a cualquier temperatura.





