Enlaces de hidrógeno
La diferencia entre el enlace de hidrógeno y el enlace puente de hidrógeno tiene su origen en que estos enlaces, desde un punto de vista electrónico, tienen unas configuraciones electrónicas distintas.
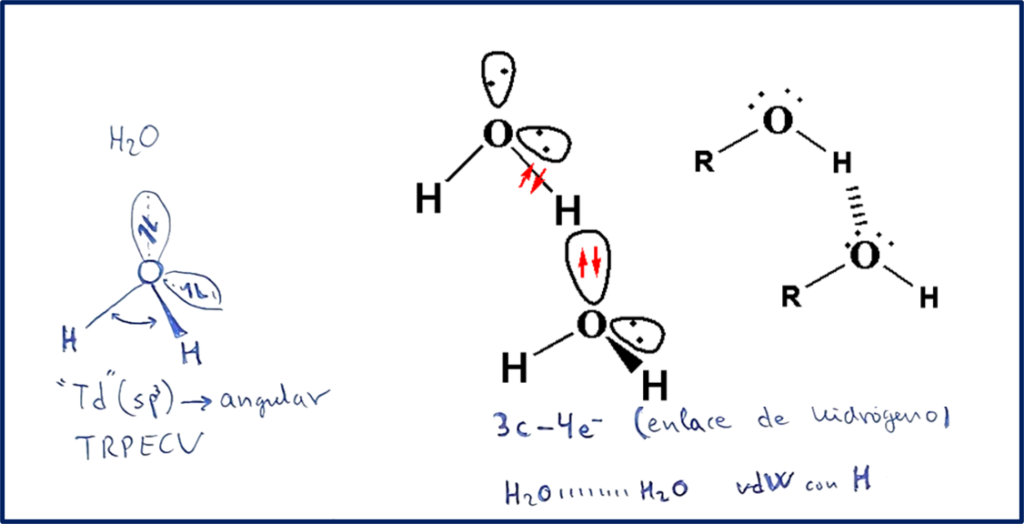
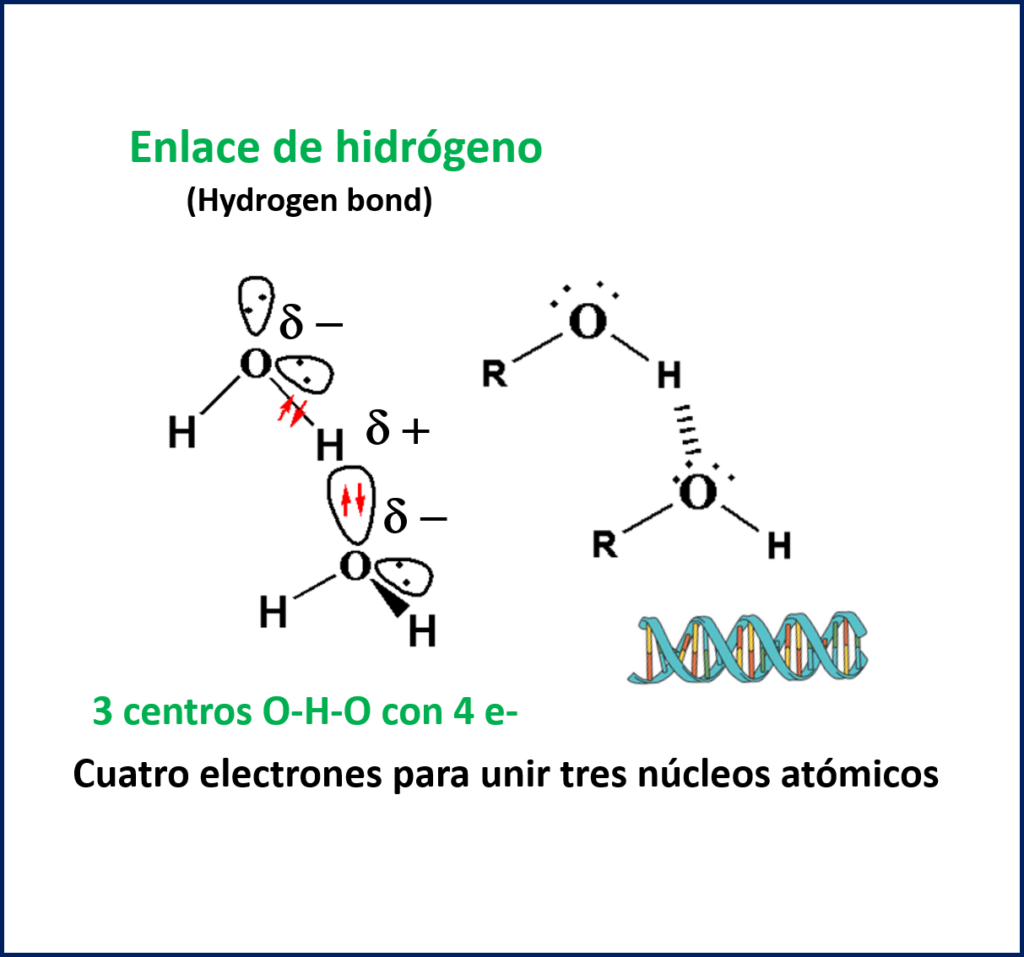
El enlace de hidrógeno observado por ejemplo en el agua, en las bases nitrogenadas constituyentes del material genético o en los aminoácidos, tiene una configuración del tipo tres centros-cuatro electrones, es decir, se dispone de un total de cuatro electrones para unir el enlace O-H-O. Estos enlaces aparecen cuando en la molécula existe al menos un enlace de tipo O-H, N-H, o F-H.
En estos casos, dado el tamaño tan pequeño de estos tres átomos (N, O, F) y su alta electronegatividad, el enlace adquiere una fuerte carga parcial electrostática y conduce a unas interacciones entre las moléculas más fuerte de lo esperado. Esta interacción no se hace notar tanto para otros casos como S-H, Cl-H, etc.
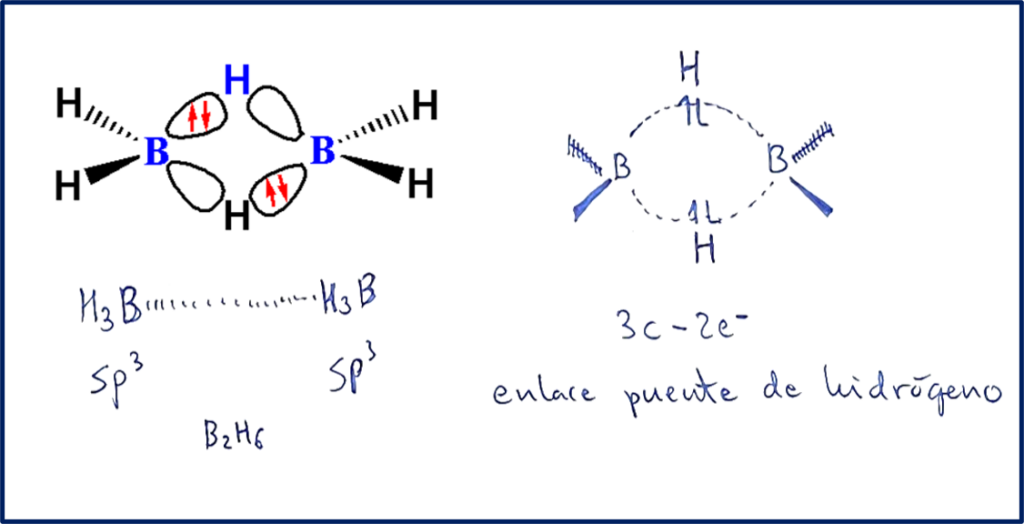
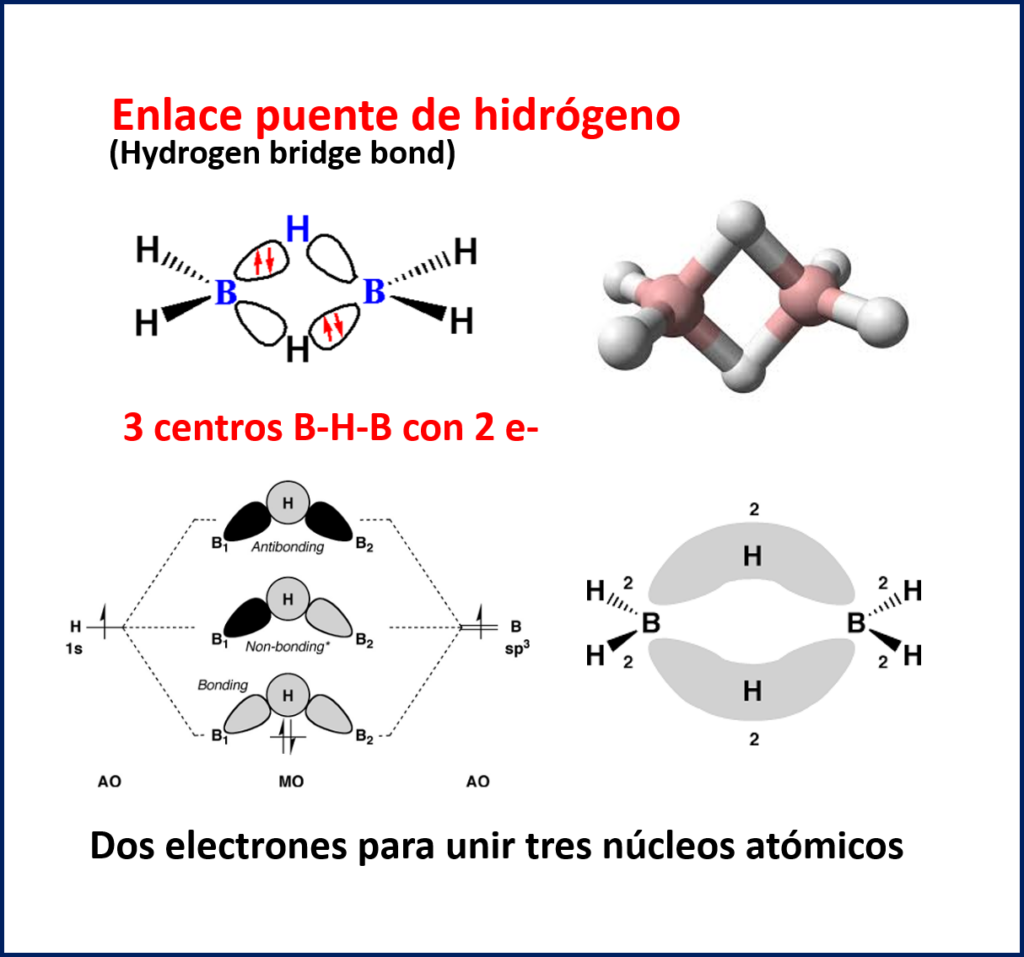
En cambio, el verdadero enlace puente de hidrógeno tiene lugar en una configuración denominada de tres centros-dos electrones. En este caso, hay solo dos electrones para unir a tres núcleos atómicos y el enlace será algo menos fuerte que el anterior. Un ejemplo de ello ocurre en el borano, BH3. Aquí la molécula se estabiliza formando un dímero donde los átomos de boro pasan de una configuración sp2 a una configuración sp3 adquiriendo la configuración de gas noble.
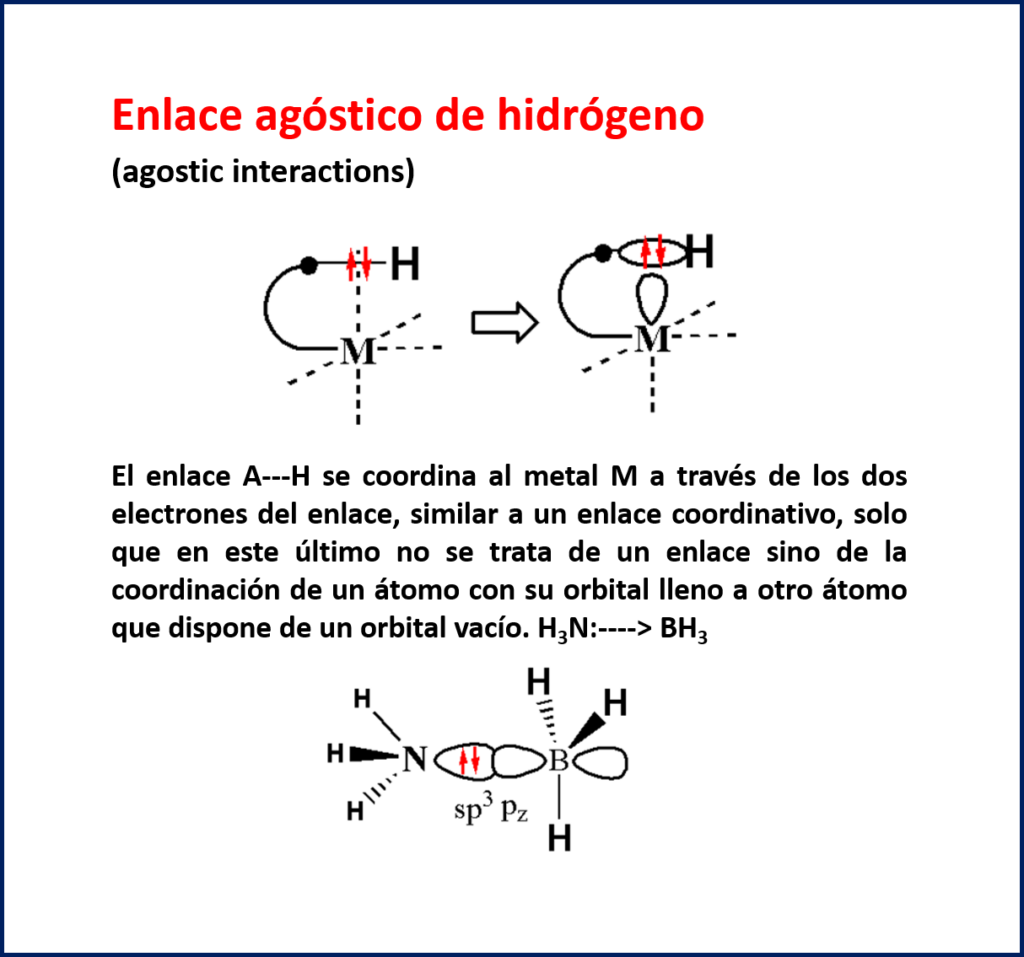
Otro enlace relacionado es el llamado enlace agóstico de hidrógeno. En este caso un enlace A—H se coordina al metal M a través de los dos electrones del enlace, similar a un enlace coordinativo, solo que en este último no se trata de un enlace sino de la coordinación de un átomo con su orbital lleno (par de e- no compartido) a otro átomo que dispone de un orbital vacío. Ejemplo observado en el aducto de Lewis: H3N:—-> BH3 (el amoniaco actúa de base de Lewis y el borano de ácido de Lewis).