«VALENCIA Y NÚMERO DE OXIDACIÓN»
DEFINICIONES IUPAC
El químico suizo Alfred Werner (1866–1919) fue uno de los que contribuyó a diferenciar el concepto de valencia «formal» de la idea de la carga que un átomo parece tener cuando forma compuestos – Premio Nobel de Química (1913).
Se define la valencia (V.A.) de un átomo como el número de electrones que utiliza para unirse a otros átomos (iguales o distintos). Esto es distinto al número de electrones disponibles de la última capa (de valencia) que tiene un átomo. Así pues, los elementos del grupo 1 tiene un e- disponible, del grupo 2 (2e-), del grupo 7 (7e-)…, del grupo 13 (3e-), del grupo 14 (4e-), del grupo 15 (5e-)…, y del grupo 18 (8e-, regla del octeto).
El estado de oxidación (E.O.) describe la carga que un átomo tendría si los electrones de cada enlace se asignaran completamente al átomo más electronegativo. Si los dos átomos del enlace son iguales, los electrones no se cuentan para el nº de oxidación. Este número es el que asociamos a la carga más común conocida para cada uno de los elementos (V 1+,3+,5+), Pt (2+,4+), S(2+,4+6+)…
EJEMPLO 1.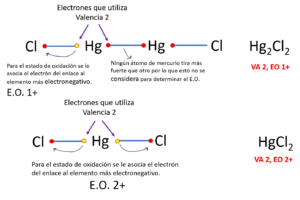
La valencia más común que se conoce para el mercurio es 2 (utiliza dos electrones cuando se une a otros átomos); sin embargo, los estados de oxidación más conocidos son 1+ y 2+.
El mercurio está en el grupo doce (12). El dos significa que tiene disponibles dos electrones en su capa de valencia para poder utilizarlos cuando se combine con otros átomos. Podría utilizar uno o los dos en sus combinaciones.
EJEMPLO 2.
El oxígeno está en el grupo 16. El 6 indica que tiene disponible seis electrones en su capa de valencia para utilizarlos cuando se combine con otros átomos. En otras palabras, podríamos encontrar para el oxígeno valencias desde uno hasta seis. La valencia más conocida es dos. Sin embargo, los estados de oxidación más conocidos son 1- (peróxidos) y 2- (óxidos).
La formación del ion oxonio (oxidanio) H3O+ tiene lugar por adición de H+ a H2O. Si contamos el número de electrones que tiene el oxígeno inicialmente (6e-) y los que le quedan finalmente al formar el ion (5e-), ha perdido un electrón. Se dice que el oxígeno adquiere una carga formal de 1+, en otros palabras, la carga del oxonio recae fundamentalmente sobre el oxígeno.
¿Sabrías asociar la valencia y el estado de oxidación del oxígeno en estos compuestos? H2O2, OH1-, O2, OF2
| Compuesto | valencia | nº de oxidación |
| H2O2 | ||
| OH1- | ||
| OF2 |
EJEMPLO 3.
El nitrógeno está en el grupo 15. El 5 indica que tiene disponible cinco electrones en su capa de valencia para utilizarlos cuando se combine con otros átomos. En otras palabras, podríamos encontrar para el nitrógeno valencias desde uno hasta cinco. Las más conocidas son tres y cinco. Sin embargo, los estados de oxidación más conocidos son 3- (NH3) y también en positivos (1,2,3,4,5): NO, NO2, N2O3, N2O5, HNOx…
La formación del ion amonio (azanio) NH4+ tiene lugar por adición de H+ a NH3. Si contamos el número de electrones que tiene el nitrógeno inicialmente (5e-) y los que le quedan finalmente al formar el ion (4e-), ha perdido un electrón. Se dice que el nitrógeno adquiere una carga formal de 1+, en otros palabras, la carga del azanio recae fundamentalmente sobre el nitrógeno.
Más información aquí
Referencias
[1] J. Chem. Educ. 2006, 83, 5, 791

