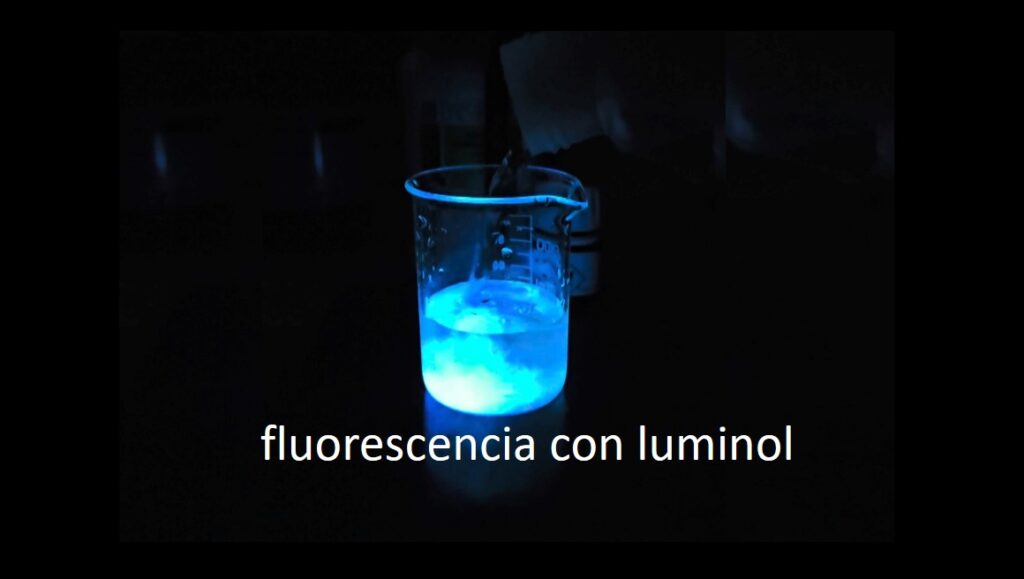
«Fluorescencia con luminol»
Los átomos o moléculas pueden ser excitados por distintos procesos, sus electrones pasan a niveles de energía superiores y pueden retornar posteriormente al nivel fundamental con emisión de luz, proceso que recibe el nombre de luminiscencia. Según la forma de excitar los átomos o moléculas, la luminiscencia recibe distintos nombres:
a) Fotoluminiscencia si es por acción de la luz.
b) Triboluminiscencia si es por fricción.
c) Electroluminiscencia si es por impacto con partículas cargadas.
d) Quimioluminiscencia si es por efecto de una reacción química (caso del luminol).
La quimioluminiscencia es un fenómeno que podemos reconocer fácilmente en algunos animales como las luciérnagas o también en las llamadas barras luminosas (light stick) que se utilizan en las acampadas o las que usan los pescadores.
Una de las sustancias más empleadas para realizar reacciones luminiscentes es el luminol; su propiedad para producir una reacción quimioluminiscente en solución básica y en presencia de un agente oxidante al contacto con la sangre fue observada por primera vez por H. O. Albrecht en 1928.
La molécula de luminol, en adelante LH2, reacciona con oxígeno molecular y en medio básico para formar un dianión dicarboxilato como especie intermedia, en adelante [L2-]*, en un estado excitado que se desactiva por fluorescencia de acuerdo con las siguientes etapas de reacción:
a) LH2 + 2 OH– + O2 → [L2-]* + 2 H2O + N2
b) [L2-]* → [L2-] + hv (fluorescencia)
Siguiendo el Esquema 2, la molécula de partida LH2 experimenta una eliminación de dos hidrógenos, dejando una carga sobre los átomos de nitrógeno que se traslada después hacia el oxígeno de cada grupo carbonilo. Posteriormente, reacciona con oxígeno molecular (acoplamiento 4+2 Diels-Alder), generándose una especie intermedia muy inestable (de alta energía), un peróxido cíclico que rompe su enlace -O-O-, liberando nitrógeno molecular como buen grupo saliente. Esto produce un dianión dicarboxilato [L2-]* en un estado excitado que posteriormente se desactiva emitiendo luz. Como esta emisión tiene su origen en una reacción química, el fenómeno se denomina quimioluminiscencia. Las reacciones quimioluminiscentes a menudo implican la escisión de un peróxido orgánico ya que este enlace es particularmente débil y se puede ganar mucha energía mediante la escisión y la subsiguiente reorganización de los enlaces.

Esquema 2. Reacción del luminol en medio acuoso. Fluorescencia emitida con l = 425 nm.
Los datos experimentales, así como los cálculos teóricos, han demostrado para el luminol el siguiente proceso de desactivación ilustrado en el Esquema 3.

Esquema 3. Secuencia de pasos para la desactivación por fluorescencia de la especie intermedia [L2-]*.
Inicialmente, el peróxido cíclico formado como especie intermedia [-O-O-], contiene dos electrones apareados en un anillo aromático. Esta especie intermedia alcanza rápidamente un estado triplete T1 de más energía, con un electrón localizado en un orbital p antienlazante del anillo aromático, y el otro, sobre un oxígeno de uno de los grupos carboxilatos asociado a un orbital con carácter antienlazante s* (léase sigma antienlazante) del enlace O—O que se está empezando a romper. Como la desactivación por fosforescencia está prohibida, el intermedio experimenta rápidamente un cruce de estados (CE) y pasa a un estado singlete S1. En este caso, la regla de selección de espín, ΔS=0, permite la vuelta al estado fundamental entre dos estados singletes, S1→S0. El orbital antienlazante s* se completa ahora con dos electrones, promoviendo así la rotura del enlace O-O que terminará finalmente en la transformación de dos orbitales atómico px en cada átomo de oxígeno.
Rendimiento cuántico.
El rendimiento cuántico del proceso FQL se utiliza para cuantificar el rendimiento de fluorescencia de manera aproximada, en relación con la intensidad I de la señal y la durabilidad del proceso quimioluminiscente. Este depende de varios factores donde FQL = FR · FES · FFL
FR = fracción de moléculas que reaccionan. (Reacting)
FES = fracción de moléculas que alcanzan el estado excitado. (Excited State)
FFL = fracción de moléculas que se desactivan por fluorescencia.
El rendimiento cuántico del luminol en agua es de FQL = 0.01 x 100 = 1 %, esto es, de 100 moléculas, solo una se desactiva por fluorescencia. El resto se desactiva por relajación vibracional (RV) hasta el estado fundamental. En DMSO, el rendimiento cuántico es del 5 %.
Reacción del luminol en medio acuoso. Características y condiciones.
Hemos visto que solo la presencia de O2 (como agente oxidante) en medio básico (OH–) es suficiente para producir la fluorescencia en las moléculas de luminol. Si empleamos agua destilada como disolvente, la concentración de oxígeno disuelto es muy baja como para producir un rendimiento adecuado. Por esta razón se ha de generar más oxígeno en el medio, empleándose la siguiente reacción redox:

El catión de hierro 3+ del hexacianoferrato(III) de potasio reacciona con peróxido de hidrógeno para producir oxígeno, el cual se aprecia por la formación de burbujas en la disolución. Este oxígeno reaccionará con luminol, en medio básico, para dar lugar a la secuencia de pasos que produce finalmente la especie activada responsable de la fluorescencia como ya se ha visto en el Esquema 2.
Demostración experimental.
Para llevar a cabo la experiencia quimioluminiscente a partir de las especies implicadas (luminol, medio básico y agente oxidante) se han de preparar las siguientes disoluciones:

Disolución A, 500 mL:
- 4 g de NaOH en unos 500 mL de agua destilada + 0.40 g de luminol (sólido gris-amarillo).
El luminol se hace más soluble a pH básico. También se necesita una base para extraer los protones de la unidad [HN-NH]. Estas disoluciones son relativamente estables (varios meses) pero han de mantenerse cerradas en la oscuridad y en un bote de plástico (el vidrio contiene trazas de metales que activan la descomposición con el oxígeno que haya disuelto en la disolución).
Para estudios cuantitativos y con objeto de obtener un rendimiento óptimo (mejor solubilidad del luminol) se ajusta el pH de la disolución a un valor de 10,5-11 con el empleo de otras combinaciones de sales, por ejemplo: NaHCO3 + Na2CO3; Na2CO3 + (NH4)2CO3…
Disolución B, 500 mL:
- 4 g de K3[Fe(CN)6], hexacianoferrato(3+) de potasio en 500 mL de agua destilada.
Algunas sales de cobre, hierro o de cobalto como por ejemplo: CuSO4, K3[Fe(CN)6], (Co(NO2)2, son utilizadas para descomponer el peróxido de hidrógeno en oxígeno molecular (el agente oxidante de la reacción) y agua. La cuestión es utilizar una reacción que produzca oxígeno en el medio de reacción de forma adecuada. Los metales también lo hacen, pero algunos experimentan una reacción fuertemente exotérmica, liberando oxígeno vigorosamente, por ejemplo: H2O2 + Pb. También se emplean otras reacciones para generar oxígeno en el medio de reacción, por ejemplo:
- a) H2O2 + NaClO (lejía) → O2 + NaCl + H2O
- b) H2O2 + KIO4 → KIO3 + O2 + H2O
Ahora solo falta incluir el peróxido de hidrógeno, H2O2, el cual se añade justo en el momento de la demostración. Para ello se procede de la siguiente manera:
-1º PASO. En una probeta de 100 mL se añaden unos 40 mL de la disolución A (Luminol + NaOH)
-2º PASO. En vaso de precipitado de 100 mL, se añaden unos 40 mL de la disolución B (sal hierro) y unas gotas (1 mL aprox.) de H2O2 al 30 % y se remueve hasta homogeneizar. ATENCIÓN: muy corrosivo.
-3º PASO. Se oscurece el lugar de la demostración experimental y se añade la disolución B sobre A.
NOTA: para la IUPAC el término agua oxigenada no está reconocido desde 2005. Se puede emplear como nombre comercial del producto químico, pero no en nomenclatura química.
Bibliografía:
[1] Bertrán R. J.; Nuñez D. J., Química Física. Ed Ariel Ciencias, Vol I (2002).[2] Experimentos de Química Clásica. The Royal Society of Chemistry. Ed Síntesis, 2002.[3] Ling Y.; Ya-Jun L., J. Chem. Theory Comput. 2019, 15, 3, 1798–1805. + Supporting Information.[4] Science in School. Spring 2016. Vol 35, pág. 30.[5] Science in School. Summer 2011. Vol 19.[6] Emil H. W.; Oliver Z.; Heinz H. K.; John H. M., J. Am. Chem. Soc. 1964, 86, 5, 940–941.[7] Cedrón, J.C., Revista de Química PUCP, 2011, Vol. 25, nº 1-2.[8] David F. Roswell, Emil H. White, Methods in Enzymology, Vol. 57, 1978, Pages 409-423.[9] Zomer, G.; Hastings, J. W.; Berthold, F.; Lundin, A.; Garcia Campana, A. M.; Niessner, R.; Christopolous, T. K.; Lowik, C.; Branchini, B.; Daunert, S.; Blum, L.; Kricka, L. J.; Roda, A. Chemiluminescence and Bioluminescence; The Royal Society of Chemistry, London, 2011.[10] Application of bioluminescence and chemiluminescence in biomedical sciences. Methods Enzymol. 2000; 305:333-45.[11] Chemical generation of excited states: the basis of chemiluminescence and bioluminescence. Methods Enzymol. 2000; 305:3-47.[12] Electronic Structure of the Chromophore in Green Fluorescent Protein (GFP) J. Am. Chem. Soc., 1998:120 (36), 9370 -9371.Documentos sobre fundamentos para el profesorado y para el alumnado:
- Experiencia con luminol para el alumnado
- Fundamentos del luminol (para el profesorado)


