OXIDADIÓN Y CORROSIÓN
Uno de los factores que limitan la vida de las piezas metálicas en servicio es el ataque físico-químico que sufren por el medio que las rodea. Los dos componentes básicos del aire son el nitrógeno (78%) y el oxígeno (21 %) y ambos tienen influencia sobre el medio. El nitrógeno apenas es activo, pero el oxígeno es el responsable máximo de casi todos los procesos de oxidación y corrosión que se dan en los materiales expuestos a su acción. Dependiendo de la forma de actuar, el oxígeno puede hacerlo:
- En ambiente seco y cálido, se provoca la oxidación de distintos materiales.
- En ambiente húmedo, y origina la corrosión de distintos materiales.
La lucha contra la corrosión es un problema muy complejo que origina serios fallos en las instalaciones industriales y domésticas, generando pérdidas económicas muy cuantiosas y dificultades para afrontar su estudio porque depende de varios factores y cada caso es específico y requiere un tratamiento particular. Aunque es un tema que afecta a todo tipo de materiales, aquí centraremos su estudio hacia la oxidación y corrosión de los metales.
OXIDACIÓN
Originalmente, el término oxidación se asignó a la combinación del oxígeno con otros elementos.
Actualmente la oxidación se define como el proceso mediante el cual hay pérdida aparente de electrones de un átomo o ión. Cuando un material se combina con el oxígeno, transformándose en óxidos más o menos complejos, se dice que experimenta una reacción de oxidación. De una forma esquemática se puede representar el proceso de oxidación de la siguiente manera:
Material + Oxígeno = Óxido del metal ± Energía
PROTECCIÓN CONTRA LA OXIDACIÓN
Los principales procedimientos para la protección contra la oxidación son los siguientes:
- Alearlo con otro material (cromo, aluminio o silicio) que posea una energía de oxidación mayor que la suya y cuya velocidad de oxidación sea menor.
- Recubrimientos superficiales, como el dorado o el cromado, si bien resultan menos efectivos que la protección por medio de aleantes, pues si se produce una rayadura en el recubrimiento o éste se agota al cabo del tiempo, el material queda en contacto directo con la atmósfera y se oxidará fácilmente.
CORROSIÓN
La corrosión es la causa general de la alteración y destrucción de la mayor parte de los materiales metálicos usados y fabricados.
Tuberías desprotegidas, enterradas bajo tierra, expuestas a la atmósfera o sumergidas en agua son objeto de la corrosión. Sin un apropiado mantenimiento, cualquier red de tuberías puede deteriorarse. La corrosión puede debilitar la tubería y convertirla en un elemento inseguro para el transporte de fluidos.
La corrosión es probablemente el problema más grande para el mantenimiento de las redes de tubería, es causada generalmente por el oxígeno atmosférico disuelto en el agua y el proceso corrosivo se detiene solamente cuando el oxígeno es eliminado del agua, o si se consume por el proceso oxidante al ser atacado el metal.
Existen varios métodos de clasificar los distintos tipos de corrosión, como son la corrosión electrolítica, la corrosión a temperatura ambiente, a altas temperaturas y la corrosión química.
LA CORROSIÓN ELECTROLÍTICA
Ocurre cuando dos metales están contacto uno con otro y tienen diferentes potenciales electrolíticos. Éste es el principal causante de la mayoría de las corrosiones encontradas en aceros.
Cuando un metal tiene un potencial negativo tiene tendencia a desprenderse de iones positivos y se denominan ánodos; por el contrario, los que tienen potencial positivo tienen tendencia a recogerlos, son los llamados metales nobles.
Si se ponen en contacto dos metales con potencial distinto, el que más potencial tiene se convierte en cátodo y el otro en ánodo; este fenómeno se aumenta con la diferencia de potencial entre ambos metales: cuanto más lejanos estén mayor será este fenómeno.
De los dos metales, el ánodo estará sometido al efecto de la corrosión y el cátodo estará protegido y se mantendrá estable.
Ejemplo_1
Cuando juntamos una tubería de acero y una tubería de cobre, el acero aumenta su ritmo de corrosión, estamos formando un par electroquímico que perjudica al acero. Se debe poner entre ambos metales una junta electrolítica que evite el contacto y la transmisión de corrientes entre ambos. Aun así, siempre debemos tener la precaución adicional de poner las tuberías de diferente par galvánico en sentido ascendente considerando el sentido de la circulación del agua. En todas las instalaciones hay rebabas y pequeños trozos de tubería cuando están recién instaladas; si instalamos una tubería de cobre antes que una de acero, los trocitos de cobre que se desprendan pueden depositarse en la tubería de acero formando una pila galvánica que
provocará la corrosión de la tubería de acero.Si, en cambio, el sentido de la circulación es al contrario, los trocitos de acero que se puedan escapar no perjudicarán la tubería de cobre.
Cobre + acero = corrosión del acero Acero + Zinc = Corrosión del Zinc Ejemplo_2
Cuando el proveedor nos vende tubería de acero galvanizado, nos está vendiendo una tubería de acero normal que ha sido sometida a un proceso de galvanización, que consiste en bañar el tubo en una balsa de zinc en estado líquido; cuando sale éste se enfría y forma una capa que envuelve el acero. Cuando la tubería se somete a la corrosión, el ánodo, en este caso el zinc, pierde masa y se oxida protegiendo el acero.
LA CORROSIÓN A TEMPERATURA AMBIENTE
Es la más común, se produce generalmente en los aceros.
LA CORROSIÓN A ALTAS TEMPERATURAS
Los metales aumentan la velocidad de la corrosión con el aumento de la temperatura.
LA CORROSIÓN QUÍMICA
Es el resultado del ataque por compuestos ácidos o alcalinos, los cuales disuelven la superficie del metal.
EFECTOS DE LA CORROSIÓN
Cuando la oxidación se produce en un ambiente húmedo o en presencia de otras sustancias agresivas para un material en concreto se denomina corrosión, y es mucho más peligrosa para la vida de los materiales que la oxidación simple, pues en un medio húmedo la capa de óxido no se deposita sobre el material, sino que se disuelve en el vapor de agua de la atmósfera, acabando por desprenderse.
Podemos definir la corrosión atmosférica como la destrucción lenta y progresiva de un material por acción combinada del oxígeno del aire y la humedad. También existe la corrosión química producida por la acción de los ácidos y álcalis.
Por lo dicho anteriormente, a efectos de corrosión son tan importantes las propiedades del medio como las del metal, y la favorecerán todos aquellos factores que influyen positivamente sobre la velocidad de reacción. Entre estos factores destacaremos:
- Las temperaturas elevadas.
- La presencia de ácidos.
- El carácter electroquímico.
- Las características del material: tipo de composición, forma de la pieza, estado superficial.
- La influencia del material. Viene determinada por las heterogeneidades químicas y estructurales.
- La influencia de la forma y superficie de la pieza. Viene determinada porque tanto los surcos de mecanizado como rayas, grietas y orificios la favorecen dificultándola por el contrario un pulido perfecto.
- La influencia del medio ambiente. Está determinada por la naturaleza del mismo (ácido. básico o salino).
PROTECCIÓN CONTRA LA CORROSIÓN
Cada situación requiere de una técnica de protección y estudio diferente; distinguiremos entre las protecciones activas contra la corrosión y las protecciones pasivas.
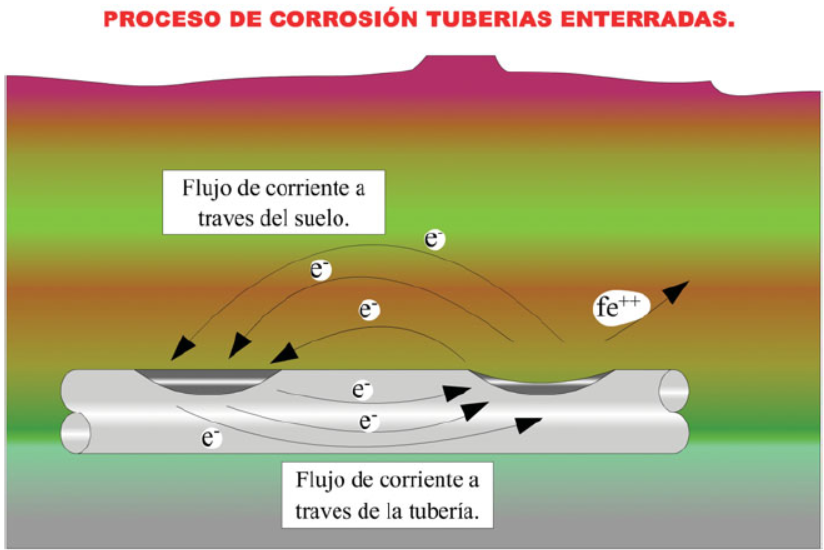
Las instalaciones enterradas están sometidas al proceso de la corrosión; cuando el terreno es conductor de la electricidad, tiene humedad, la propia tubería genera pilas galvánicas que generan zonas anódicas que desprenden cationes que reaccionan con el oxigeno disuelto en el agua para formar óxidos y descomponer la tubería; véase dibujo.
PROTECCIÓN CATÓDICA PASIVA
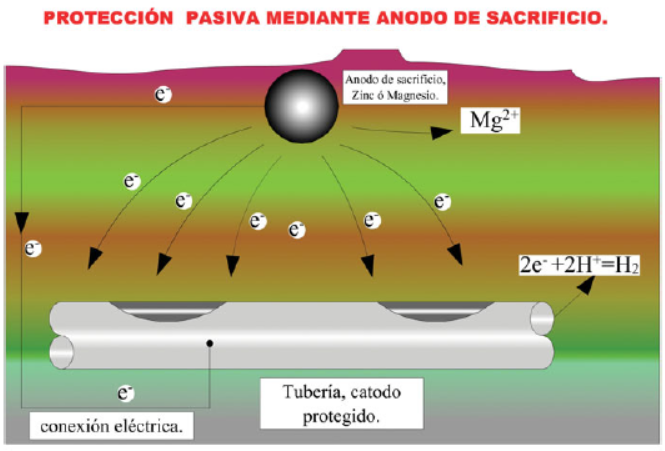
Una forma de corregir este fenómeno de corrosión enterrada es utilizando la técnica de protección pasiva por ánodos de sacrificio.
Se coloca una pieza de un metal más electronegativo que la tubería a enterrar en contacto con el terreno (generalmente, zinc o magnesio), conectada eléctricamente a la tubería mediante un cable conductor.
Una vez realizada la instalación del ánodo de sacrificio, la tubería se convierte en un cátodo protegido y el metal de sacrificio empieza a descomponerse.
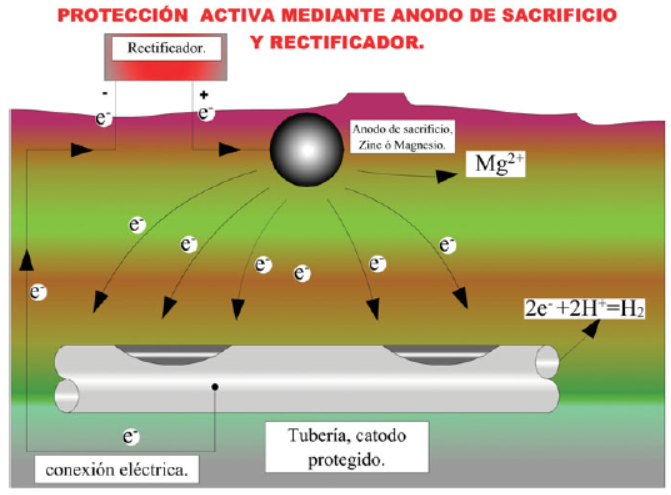
PROTECCIÓN CATÓDICA ACTIVA
Una variante de esta técnica, que resulta más eficaz, pero más costosa, es la llamada de “protección activa” o “protección de corrientes dirigidas”. Consiste en colocar un rectificador que obliga a circular la corriente; de esta manera la protección depende menos de la casuística que se origina en la conductividad del terreno (véase figura).
RECUBRIMIENTOS Y REVESTIMIENTOS
Una manera lógica de proteger los materiales de las instalaciones es aislarlos del medio corrosivo: si no está en contacto con la atmósfera, con el terreno o con el medio que inicia el proceso de la corrosión, ésta no se producirá o se retrasará hasta que el recubrimiento se deteriore por el paso del tiempo o por interferencias externas (golpes, rozaduras, etc.).
Es un método que se suele emplear solo o como complemento a la protección por ánodos de sacrificio; consiste en recubrir el material con pinturas, plásticos o recubrimientos electrolíticos.
SELECCIÓN DE MATERIALES
Es de pura lógica que la forma más razonable de luchar contra la corrosión sea la selección de materiales que no la padezcan o que tengan una durabilidad aceptable; deberemos pensar en aceros inoxidables, materiales plásticos, aceros protegidos, galvanizados, etc.
En el diseño de la instalación es fundamental conocer el medio en el que los materiales van a colocarse y prever los problemas antes de que surjan.




